Elektronaffinitás
Mit is jelent az a kifejezés, hogy affinitás? Talán elsőre bonyolultnak tűnhet, de ha azt kérdezem tőled, hogy van-e affinitásod pl. a sportokhoz, akkor biztosan érted, hogy azt kérdezem, hogy mennyire szereted a sportokat. Nem bonyolultabb ennél az elektronaffitnitás sem. Azt jelenti, hogy egy atom semleges állapotában vajon milyen affinitást "érez", ha megkínáljuk egy plusz elektronnal. Szeretné-e? Vagy háta közepére sem kívánja?
Az elektronaffitnitás fogalmával kapcsolatban sajnos a világ még nem jutott konszenzusra, hogy mit is akar pontosan annak nevezni. De ami a nagyobb baj, hogy sajnos a középiskolás tananyag sem. Ellentmondó fogalmakat olvashatunk a tankönyvekben, és a segédanyagokban.
Az egyik tankönyv ezt írja:
Az elektronaffinitás az energiát jelenti, amely akkor szabadul fel, vagy nyelődik el, ha 1 mol alapállapotú szabad (gázhalmazállapotú) atomból egyszeresen negatív töltésű ion keletkezik.
A fluor atomot tekintve példának, a definíció szerint ezt a folyamatot írja le:
A folyamat során 340 kj/mol energia szabadul fel. A felszabadulás a - (mínusz) előjel jelzi. Ez azt jelenti, hogy a fluor atom még energiát is adott érte a környezetének, csak hogy felvehesse azt az elektront, akkora az elektronaffinitása. Azaz, ha a fluoratomot megkínáljuk elektronnal, szívesen fogadja, kifejezetten örül neki, hiszen így elérheti a nemesgáz-szerkezetet. Ennél kevésbé boldogabb egy nátrium, vagy lítium, akik a periódusos rendszer I. főcsoportjában vannak, és a saját külső elektronjukat is inkább leadnák, nem hogy még egyet pluszba fel is vegyenek.
Egy másik, középiskolások által forgatott könyv (függvénytáblázat - NAT 2012) már így fogalmaz:
1 mol gázállapotú egyszeresen negatív töltésű ionból a töltést okozó elektron eltávolításához szükséges, vagy felszabadult energiát elektronaffinitásnak nevezzük.
Ez viszont az előzőekben felvázolt folyamattal ellentétes irányú változást jelent:
A két folyamat ellentétes előjelű értékkel jellemezhető!
Ráadásul mind az ionizációs energia, mind az elektronaffinitás fogalma megerőszakolt fogalmak. Gáz fázisban lévő szabad atomokra és ionokra vonatkoztat. Ilyen a természetben ritkán fordul elő. És ez elektronaffintiás definíciója az említettek alapján nem is vonatkozhat a 2x-esen negatív töltésű ionok képződésére.
Mégis a tananyag része...
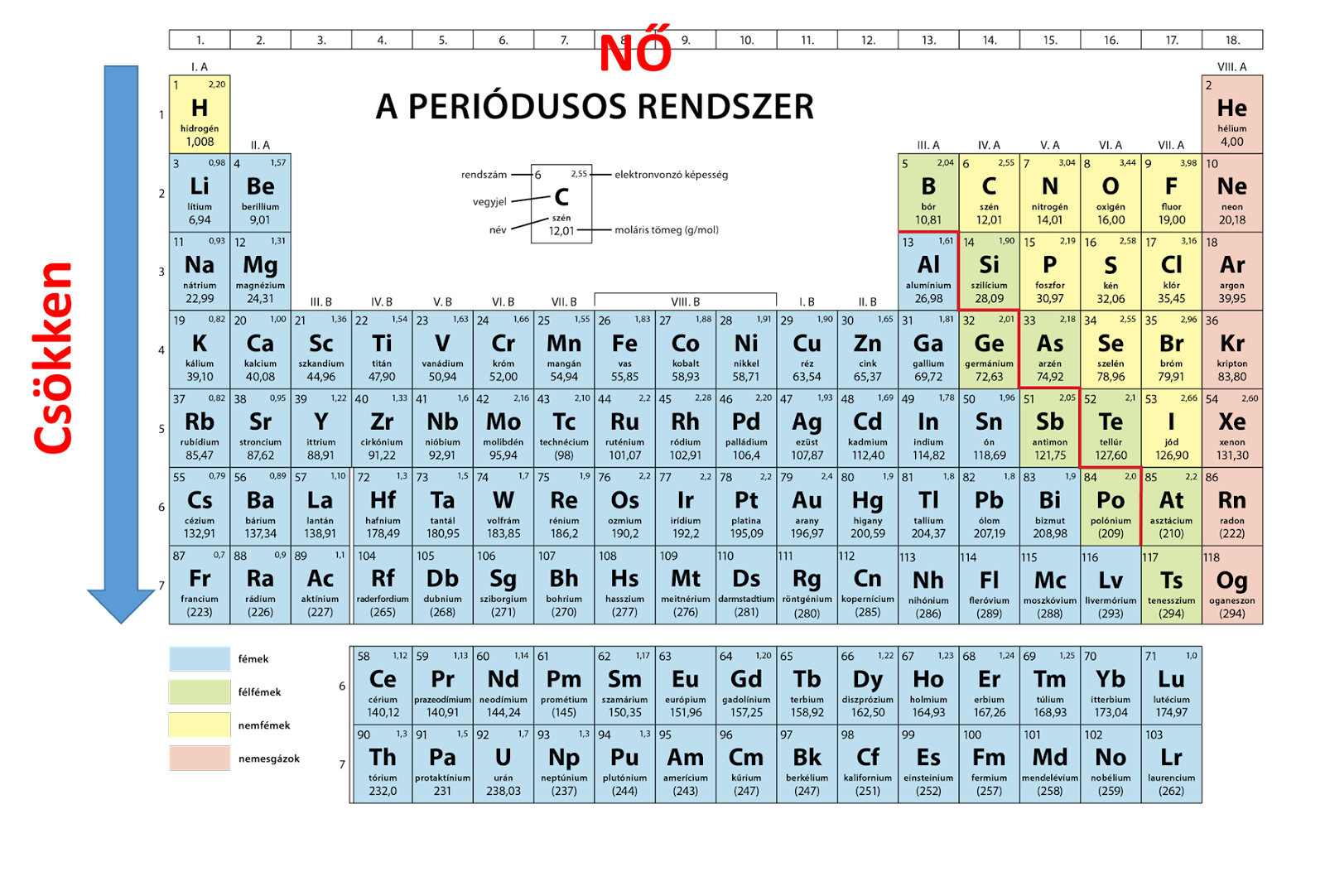
A periódusos rendszerben az elemek elektronhoz való affinitása a következőek alapján változik:
További hasznos leckék:


Megjegyzések
Megjegyzés küldése